Общая характеристика элементов V-А группы. Р-Элементы V группы Максимальная валентность элементов 5 группы главной подгруппы
Сходство элементов:
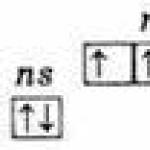
Одинаковая структура внешнего электронного слоя атомов ns 2 np 3 ;
Р-элементы;
Высшая с. о. равна +5;
Низшая с. о. равна -3 (для Sb и Bi малохарактерна).
Для элементов главной подгруппы V группы иногда используется групповое название «пниктогены», введенное по аналогии с термином «галогены» и «халькогены» и образованное от символов элементов фосфора Р и азота N.
Валентные состояния атомов
Для атомов Р, As, Sb, Bi возможны 2 валентных состояния:
Основное ns 2 np 3
Возбужденное ns 1 np 3 nd 1
Отличие азота от других элементов подгруппы
1. В связи с отсутствием в атоме азота d-орбиталей на внешнем электронном слое число ковалентных свяязей, образуемых атомом азота по обменному механизму, не может быть больше 3-х.
2. Наличие неподеленной электронной пары на 2s-подуровне атома азота обусловливает возможность образования ковалентной связи по донорно-акцепторному механизму. Таким образом, высшая валентность N равна IV.
3. В соединениях с кислородом азот проявляет степени окисления +1, +2, +3, +4, +5.
Вертикальное изменение свойств элементов и образуемых ими веществ
В отличие от галогенов и халькогенов, в главной подгруппе V группы наблюдается более резкое изменение свойств элементов и образуемых ими простых веществ по мере увеличения заряда ядра и радиуса атомов:
Вертикальное изменение свойств элементов и образуемых ими простых веществ |
|||||
неметаллы |
металл с некоторыми признаками неметалличности |
||||
Оксиды и гидроксиды |
Азот и его кислородные соединения рассматриваются отдельно, в силу целого ряда отличий. |
||||
Э 2 O 3 и соответствующие гидроксиды |
Р 2 O 3 (Р 4 O 6) кислотный оксид |
As 2 O 3 кислотный оксид с признаками амфотерности |
Sb 2 O 3 амфотерный оксид |
Bi 2 O 3 основный оксид |
|
Э 2 O 5 и соответствующие гидроксиды |
Р 2 O 5 (Р 4 O 10) кислотный оксид |
As 2 O 5 кислотный оксид |
Sb 2 O 5 кислотный оксид |
Bi 2 O 5 амфотерный непрочный |
|
HPO 3 (H 3 PO 4) |
|||||
слабые кислоты |
|||||
Кислотные свойства ослабевают |
|||||
Основные свойства усиливаются |
|||||
Соединения с водородом ЭН 3
Элементы главной подгруппы V группы образуют летучие соединения с водородом, представляющие собой ядовитые газы с характерными запахами. Являются сильными восстановителями. В отличие от водородных соединений неметаллов VII и VI групп, в водных растворах не образуют ионов Н + т. е. не проявляют кислотных свойств.
ОБЩАЯ ХАРАКТЕРИСТИКА 5-Й ГРУППЫ ЭЛЕМЕНТОВ.
К главной подгруппе V 0 01 F группы периодической системы принад лежат азот, фосфор, мышьяк, сурьма и висмут. Эти элементы, имея пять электронов в наружном слое атома, характеризуются в целом
как неметаллы. Однако способность к присоединению электронов выражена у них значительно слабее, чем у соответствующих элементов VI и VII групп. Благодаря наличию пяти наружных электронов, высшая положительная окисленность элементов этой подгруппы равна -5, а отрицательная - 3. Вследствие относительно меньшей электроотрицательности связь рассматриваемых элементов с водородом менее полярна, чем связь с водородом элементов VI и VII групп. Поэтому водородные соединения этих элементов не отщепляют в водном растворе ионы водорода H, таким образом, не обладают кислотными свойствами. Физические и химические свойства элементов подгруппы азота изменяются с
0 0 1 Fувеличением порядкового номера в той же последо вательности, которая наблюдалась в
0 0 1 Fранее рассмотренных груп пах, Но так как неметаллические свойства выражены у
слабее, чем у кислорода и тем более фтора, то ослабление этих свойств при переходе к 0 0 1 Fследующим элементам влечет за собой по явление и нарастание металлических свойств.
Последние заметны уже у мышьяка, сурьма приблизительно в равной степени обладает теми и другими свойствами, а у висмута металлические свойства преобладают над неметаллическими. ОПИСАНИЕ ЭЛЕМЕНТОВ. АЗОТ (от греч. ázōos - безжизненный, лат. Nitrogenium), N, химический элемент V
группы периодической системы Менделеева, атомный номер 7, атомная масса 14,0067; бесцветный газ, не имеющий запаха и вкуса. Историческая справка. Соединения азота - селитра, азотная кислота, аммиак - были
известны задолго до получения азота в свободном состоянии. В 1772 Д. Резерфорд, сжигая фосфор и др. вещества в стеклянном колоколе, показал, что остающийся после сгорания газ, названный им "удушливым воздухом", не поддерживает дыхания и горения. В 1787 А. Лавуазье установил, что "жизненный" и "удушливый" газы, входящие в состав воздуха, это простые вещества, и предложил название "азот". В 1784 Г. Кавендиш показал, что азот входит в состав селитры; отсюда и происходит латинское название азот (от позднелатинское nitrum - селитра и греческое gennao - рождаю, произвожу), предложенное в 1790 Ж. А. Шапталем. К началу 19 в. были выяснены химическая инертность азота в свободном состоянии и исключительная роль его в соединениях с др. элементами в качестве связанного азота. С тех пор "связывание" азота воздуха стало одной из важнейших технических проблем химии. Распространённость в природе. Азот - один из самых распространённых элементов на
Земле, причём основная его масса (около 4´1015 т ) сосредоточена в свободном состоянии в атмосфере. В воздухе свободный азот (в виде молекул N2) составляет 78,09% по объёму (или 75,6% по массе), не считая незначительных примесей его в виде аммиака и окислов. Среднее содержание азота в литосфере 1,9´10-3% по массе. Природные соединения азота. - хлористый аммоний NH4Cl и различные нитраты (см.
Селитры.) Крупные скопления селитры характерны для сухого пустынного климата (Чили, Средняя Азия). Долгое время селитры были главным поставщиком азота для промышленности (сейчас основное значение для связывания азота имеет промышленный синтез аммиака из азота воздуха и водорода). Небольшие количества связанного азота находятся в каменном угле (1-2,5%) и нефти (0,02-1,5%), а также в водах рек, морей и океанов. Азот накапливается в почвах (0,1%) и в живых организмах (0,3%).
Хотя название "азот" означает "не поддерживающий жизни", на самом деле это - необходимый для жизнедеятельности элемент. В белке животных и человека содержится 16 - 17% азота. В организмах плотоядных животных белок образуется за счёт потребляемых белковых веществ, имеющихся в организмах травоядных животных и в растениях. Растения синтезируют белок, усваивая содержащиеся в почве азотистые вещества, главным образом неорганические. Значительные количества азота поступают в почву благодаря азотфиксирующим микроорганизмам, способным переводить свободный азот воздуха в соединения азота. В природе осуществляется круговорот азота, главную роль в котором играют
микроорганизмы - нитрофицирующие, денитрофицирующие, азотфиксирующие и др. Однако в результате извлечения из почвы растениями огромного количества связанного азота (особенно при интенсивном земледелии) почвы оказываются обеднёнными азотом. Дефицит азота характерен для земледелия почти всех стран, наблюдается дефицит азота и в животноводстве ("белковое голодание"). На почвах, бедных доступным азотом, растения плохо развиваются. Азотные удобрения и белковая подкормка животных - важнейшее средство подъёма сельского хозяйства. Хозяйственная деятельность человека нарушает круговорот азота. Так, сжигание топлива обогащает атмосферу азотом., а заводы, производящие удобрения, связывают азот воздуха. Транспортировка удобрений и продуктов сельского хозяйства перераспределяет азот на поверхности земли. Азот - четвёртый по распространённости элемент Солнечной системы (после водорода,
гелия и кислорода). Изотопы, атом, молекула. Природный азот состоит из двух стабильных изотопов: 14N
(99,635%) и 15N (0,365%). Изотоп 15N применяют в химических и биохимических исследованиях в качестве меченого атома. Из искусственных радиоактивных изотопов азота наибольший период полураспада имеет 13N (T1/2 - 10,08 мин ), остальные весьма короткоживущие. В верхних слоях атмосферы, под действием нейтронов космического излучения, 14N превращается в радиоактивный изотоп углерода 14C. Этот процесс используют и в ядерных реакциях для получения 14C. Внешняя электронная оболочка атома азота. состоит из 5 электронов (одной неподелённой пары и трёх неспаренных - конфигурация 2s 22p 3). Чаще всего азот. в соединениях З-ковалентен за счёт неспаренных электронов (как в аммиаке NH3). Наличие неподелённой пары электронов может приводить к образованию ещё одной ковалентной связи, и азот становится 4-ковалентным (как в ионе аммония NH4+). Степени окисления азота меняются от +5 (в N205) до -3 (в NH3). В обычных условиях в свободном состоянии азот образует молекулу N2, где атомы N связаны тремя ковалентными связями. Молекула азота очень устойчива: энергия диссоциации её на атомы составляет 942,9 кДж/моль (225,2 ккал/моль ), поэтому даже при t около 3300°C степень диссоциации азот. составляет лишь около 0,1%. Физические и химические свойства. Азот немного легче воздуха; плотность 1,2506 кг/
м3 (при 0°C и 101325 н/м2 или 760 мм рт. ст. ), tпл -209,86°C, tкип -195,8?C. А. сжижается с трудом: его критическая температура довольно низка (-147,1 °C), а критическое давление высоко 3,39 Мн/м2 (34,6 кгс/см2 ); плотность жидкого азота 808 кг{м3. В воде азот менее растворим, чем кислород: при 0°C в 1 м3 Н2О растворяется 23,3 г азота. Лучше, чем в воде, азот растворим в некоторых углеводородах. Только с такими активными металлами, как литий, кальций, магний, азот
взаимодействует при нагревании до сравнительно невысоких температур. С большинством других элементов азот реагирует при высокой температуре и в присутствии катализаторов. Хорошо изучены соединения азота с кислородом N2O, NO, N2O3, NO2 и N2O5. Из них при непосредственном взаимодействии элементов (4000оC) образуется окись NO, которая при охлаждении легко окисляется далее до двуокиси NO2. В воздухе окислы азота образуются при атмосферных разрядах. Их можно получить также действием на смесь азота с кислородом ионизирующих излучений. При растворении в воде азотистого N2О3 и
азотного N2О5 ангидридов соответственно получаются азотистая кислота HNO2 и азотная кислота HNO3, образующие соли - нитриты и нитраты. С водородом азот соединяется только при высокой температуре и в присутствии катализаторов, при этом образуется аммиак NH3. Кроме аммиака, известны и другие многочисленные соединения азота с водородом, например гидразин H2N-NH2, диимид HN-NH, азотистоводородная кислота HN3(H-N-NºN), октазон N8H14 и др.; большинство соединений азота с водородом выделено только в виде органических производных. С галогенами азот непосредственно не взаимодействует, поэтому все галогениды азот получают только косвенным путём, например фтористый азот NF3- при взаимодействии фтора с аммиаком. Как правило, галогениды азота - малостойкие соединения (за исключением NF3); более устойчивы оксигалогениды азота - NOF, NOCI, NOBr, N02F и NO2CI. С серой также не происходит непосредственного соединения азота; азотистая сера N4S4 получается в результате реакции жидкой серы с аммиаком. При взаимодействии раскалённого кокса с азотом образуется циан (CN).;. Нагреванием азота с ацетиленом C2H2 до 1500оC может быть получен цианистый водород HCN. Взаимодействие азота с металлами при высоких температурах приводит к образованию нитридов (например, Mg3N2). При действии на обычный азот электрических разрядов [давление 130 - 270 н/м2 (1- 2
мм рт ст )] или при разложении нитридов В, Ti, Mg и Са, а также при электрических разрядах в воздухе может образоваться активный азот, представляющий собой смесь молекул и атомов азот, обладающих повышенным запасом энергии. В отличие от молекулярного, активный азот весьма энергично взаимодействует с кислородом, водородом, парами серы, фосфором и некоторыми металлами. Азот входит в состав очень многих важнейших органических соединений (амины,
аминокислоты, нитросоединения и др.). Получение и применение. В лаборатории азот легко может быть получен при
нагревании концентрированного раствора нитрита аммония: NH4NO2 - N2 + 2H2О. Технический способ получения азота основан на разделении предварительно сжиженного воздуха, который затем подвергается разгонке. Основная часть добываемого свободного азота используется для промышленного
производства аммиака, который затем в значительных количествах перерабатывается на азотную кислоту, удобрения, взрывчатые вещества и т. д. Помимо прямого синтеза аммиака из элементов, промышленное значение для связывания азота воздуха имеет разработанный в 1905 цианамидный метод, основанный на том, что при 1000оC карбид кальция (получаемый накаливанием смеси извести и угля в электрической печи) реагирует со свободным азотом: СаС2 + N2 = CaCN2 + С. Образующийся цианамид кальция при действии перегретого водяного пара разлагается с выделением аммиака:
CaCN+ЗН2О=СаСО3+2NH3.
Свободный азот применяют во многих отраслях промышленности: как инертную среду при разнообразных химических и металлургических процессах, для заполнения свободного пространства в ртутных термометрах, при перекачке горючих жидкостей и т. д. Жидкий азот находит применение в различных холодильных установках. Его хранят и транспортируют в стальных сосудах Дьюара, газообразный азот в сжатом виде - в баллонах. Широко применяют многие соединения азота производство связанного азота стало усиленно развиваться после 1-й мировой войны и сейчас достигло огромных масштабов.
Фосфор (лат. Phosphorus), Р, химический элемент V группы периодической системы Менделеева, атомный номер 15, атомная масса 30,97376, неметалл. Природный фосфор состоит из одного стабильного изотопа 31P; получено шесть искусственных радиоактивных изотопов: 28P (T1 /2 - 6,27 сек ), 29P (T1 /2 - 4,45 сек); 30P (T1 /2 - 2,55 мин ), 31P (T1 /2
14,22 сут ), 32P (T1 /2 - 25 сут ), 33P (T1 /2 - 12,5 сек ). Наибольшее значение имеет 32P, обладающий значительной энергией b-излучения и применяемый в химических и биохимических исследованиях в качестве меченого атома. Историческая справка. По некоторым литературным данным, способ получения
фосфор был известен ещё араб. алхимикам 12 в. Но общепринятой датой открытия фосфора считается 1669, когда Х. Бранд (Германия) при прокаливании с песком сухого остатка от выпаривания мочи и последующей перегонкой без доступа воздуха получил светящееся в темноте вещество, названное сначала "холодным огнем", а позднее фосфор от греч. phosphóros - светоносный. Вскоре способ получения фосфора стал известен нем. химикам - И. Крафту, И. Кункелю; в 1682 об этом способе было опубликовано. В 1743 А. С. Маргграф разработал следующий способ получения фосфора.: смесь хлорида свинца с мочой выпаривалась досуха и нагревалась до прекращения выделения летучих продуктов; остаток смешивали с древесным углём в порошке и подвергали перегонке в глиняной реторте; пары фосфора конденсировались в приёмнике с водой. Наиболее простой метод получения фосфора прокаливанием костяной золы с углём был предложен лишь в 1771 К. Шееле. Элементарную природу фосфора установил А. Лавуазье. Во 2-й половине 19 в. возникло промышленное производство фосфора из фосфоритов в ретортных печах; в начале 20 в. они были заменены электрическими печами. Распространение в природе. Среднее содержание фосфора в земной коре (кларк) -
9,3×10-2% по массе; в средних горных породах 1,6×10-1, в основных породах 1,4×10-1, меньше в гранитах и др. кислых изверженных породах - 7×10-2 и ещё меньше в ультраосновных породах (мантии) - 1,7×10-2%; в осадочных горных породах от 1,7×10-2 (песчаники) до 4×10-2% (карбонатные породы). Фосфор принимает участие в магматических процессах и энергично мигрирует в биосфере. С обоими процессами связаны его крупные накопления, образующие промышленные месторождения апатитов и фосфоритов. Фосфор - исключительно важный биогенный элемент, он накапливается многими организмами. С биогенной миграцией связаны многие процессы концентрации фосфора в земной коре. Из вод фосфор легко осаждается в виде нерастворимых минералов или захватывается живым веществом. Поэтому в морской воде лишь 7×10-6% фосфора. Известно около 180 минералов фосфора, в основном - это различные фосфаты, из которых наиболее распространены фосфаты кальция . Физические свойства. Элементарный фосфор существует в виде нескольких
аллотропических модификаций, главная из которых - белая, красная и чёрная. Белый фосфор - воскообразное, прозрачное вещество с характерным запахом, образуется при конденсации паров фосфора. Белый фосфор в присутствии примесей - следов красного фосфора, мышьяка, железа и т.п. - окрашен в жёлтый цвет, поэтому товарный белый фосфор. называется жёлтым. Существуют две формы белого фосфора: a- и b-форма. a- модификация представляет собой кристаллы кубической системы (а - 18,5); плотность 1,828 г/см3 , t пл 44,1 °C, t кип 280,5 оC, теплота плавления 2,5 кдж/моль P4 (0,6 ккал/моль P4), теплота испарения 58,6 кдж/моль Р4(14,0 ккал/моль P4), давление пара при 25 °C 5,7 н/м2 (0,043 мм рт. ст. ). Коэффициент линейного расширения в интервале температур от 0 до 44 °C равен 12,4×10-4, теплопроводность 0,56 вт/ (м ×К) при 25 °C. По электрическим свойствам белый фосфор. близок к диэлектрикам: ширина запрещенной зоны около 2,1 эв, удельное электросопротивление 1,54×1011 ом ×см, диамагнитен, удельная магнитная восприимчивость - 0,86×10-6. Твёрдость по Бринеллю 6 Мн/м2 (0,6 кгс/мм2 ). a-форма белого фосфора хорошо растворяется в сероуглероде, хуже - в жидком аммиаке, бензоле, четырёххлористом углероде и др. При - 76,9 °C и давлении 0,1 Мн/м2 (1 кгс/см2 ) a-форма переходит в низкотемпературную b-форму (плотность 1,88 г/ см3 ). С повышением давления до 1200 Мн/м2 (12 тыс. кгс/см2 ) переход происходит при 64,5 °C. b-форма - кристаллы с двойным лучепреломлением, их структура окончательно не установлена. Белый фосфор ядовит: на воздухе при температуре около 40 °C
самовоспламеняется, поэтому его следует хранить под водой (растворимость в воде при 25 °C 3,3×10-4%). Нагреванием белого фосфора без доступа воздуха при 250-300 °C в течение нескольких часов получают красный фосфор. Переход экзотермичен, ускоряется ультрафиолетовыми лучами, а также примесями (иод, натрий, селен). Обычный товарный красный фосфор практически полностью аморфен; имеет цвет от тёмно-коричневого до фиолетового. При длительном нагревании, необратимо может переходить в одну из кристаллических форм (триклинную, кубическую и др.) с различными свойствами: плотностью от 2,0 до 2,4 г/см 3, t пл от 585 до 610 °C при давлении в несколько десятков атмосфер, температурой возгонки от 416 до 423 °C, удельным электросопротивлением от 109 до 1014 ом ×см. Красный фосфор на воздухе не самовоспламеняется; вплоть до температуры 240-250 °C, но самовоспламеняется при трении или ударе; нерастворим в воде, а также в бензоле, сероуглероде и др., растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор. При нагревании белого фосфора до 200-220 °C под давлением (1,2-1,7)×103Мн/м 2
[(12-17)×103 кгс/см 2] образуется чёрный фосфор. Это превращение можно осуществить без давления, но в присутствии ртути и небольшого количества кристаллов чёрного фосфора (затравки) при 370 °C в течение 8 сут. Чёрный фосфор представляет собой кристаллы ромбической структуры (а -3,31 , b - 4,38 , с -10,50), решётка построена из волокнистых слоев с характерным для фосфор. пирамидальным расположением атомов, плотность 2,69 г/см3, t пл около 1000 °C под давлением 1,8×103 Мн/м2 (18×103 кгс/см2 ). По внешнему виду чёрный фосфор похож на графит; полупроводник: ширина запрещенной зоны 0,33 эв при 25 °C; имеет удельное электросопротивление 1,5 ом ×см, температурный коэффициент электросопротивления 0,0077, диамагнитен, удельная магнитная восприимчивость - 0,27×10-6. При нагревании до 560-580 °C под давлением собственных паров превращается в красный фосфор. Чёрный фосфор малоактивен, с трудом воспламеняется при поджигании, поэтому его можно безопасно подвергать механической обработке на воздухе. Атомный радиус фосфора 1,34 , ионные радиусы: P5 + 0,35 , P3 + 0,44 , P3- 1,86 .
Атомы фосфора объединяются в двухатомные (P2), четырёхатомные (P4) и полимерные молекулы. Наиболее стабильны при нормальных условиях полимерные молекулы, содержащие длинные цепи связанных между собой P4 - тетраэдров. В жидком, твёрдом виде (белый фосфор) и в парах ниже 800 °C фосфор состоит из молекул P4. При температурах выше 800 °C молекулы P4 диссоциируют на P2, которые, в свою очередь, распадаются на атомы при температуре свыше 2000 °C. Только белый фосфор состоит из молекул P4, все остальные модификации - полимеры. Химические свойства. Конфигурация внешних электронов атома фосфор 3s2 3p3, в
соединениях наиболее характерны степени окисления + 5, + 3, и - 3. Подобно азоту, фосфор в соединениях главным образом ковалентен. Ионных соединений, подобных фосфидам Na3P, Ca3P2, очень мало. В отличие от азота, фосфор обладает свободными 3d - opбиталями с довольно низкими энергиями, что приводит к возможности увеличения координационного числа и образованию донорно-акцепторных связей. Фосфор химически активен, наибольшей активностью обладает белый фосфор;
красный и чёрный фосфор в химических реакциях гораздо пассивнее. Окисление белого фосфора происходит по механизму цепных реакций. Окисление фосфора обычно сопровождается хемилюминесценцией. При горении фосфора в избытке кислорода образуется пятиокись P4O10 (или P2O5), при недостатке - в основном трёхокись P4O6 (или P2O3). Спектроскопически доказано существование в парах P4O7, P4O8, P2O6, PO и др. фосфора окислов. Пятиокись фосфора получают в промышленных масштабах сжиганием элементарного фосфора в избытке сухого воздуха. Последующая гидратация P4O10 приводит к получению орто- (Н3РО4) и поли- (Нn + 2 Pn O3п + 1) фосфорных кислот. Кроме
того, фосфор образует фосфористую кислоту H3PO3, фосфорноватую кислоту H4P2O6 и фосфорноватистую кислоту H3PO2, а также надкислоты: надфосфорную H4P2O8 и мононадфосфорную H3PO5 Широкое применение находят соли фосфорных кислот (фосфаты), в меньшей степени - фосфиты и гипофосфиты. Фосфор непосредственно соединяется со всеми галогенами с выделением большого
количества тепла и образованием тригалогенидов (PX3, где Х - галоген), пентагалогенидов (PX5) и оксигалогенидов (например, POX3). При сплавлении фосфора с серой ниже 100 °C образуются твёрдые растворы на основе фосфор и серы, а выше 100 °C происходит экзотермическая реакция образования кристаллических сульфидов P4S3, P4S5, P4S7, P4S10, из которых только P4S5 при нагревании выше 200 °C разлагается на P4S3 и P4S7, а остальные плавятся без разложения. Известны оксисульфиды фосфора: P2O3S2, P2O3S3, P4O4S3, P6O10S5 и P4O4S3. Фосфор по сравнению с азотом менее способен к образованию соединений с водородом. Фосфористый водород фосфин PH3 и дифосфин P2H4 могут быть получены только косвенным путём. Из соединений фосфор с азотом известны нитриды PN, P2N3, P3N5 - твёрдые, химически устойчивые вещества, полученные при пропускании азота с парами фосфора через электрическую дугу; полимерные фосфонитрилгалогениды - (PNX2) n (например, полифосфонитрилхлорид), полученные взаимодействием пентагалогенидов с аммиаком при различных условиях; амидоимидофосфаты - соединения, как правило, полимерные, содержащие наряду с Р-О-Р связями Р-NH-Р связи. При температурах выше 2000оC фосфор реагирует с углеродом с образованием
карбида PC3 - вещества, не растворяющегося в обычных растворителях и не взаимодействующего ни с кислотами, ни со щелочами. При нагревании с металлами фосфор образует фосфиды. Фосфор образует многочисленные фосфорорганические соединения. Получение. производство элементарного фосфора осуществляется
электротермическим восстановлением его из природных фосфатов (апатитов или фосфоритов) при 1400-1600 °C коксом в присутствии кремнезёма (кварцевого песка):
2Ca3(PO4)2 + 10C + n SiO2 = P4 + 10CO + 6CaO×n SiO2 Предварительно измельченная и обогащенная фосфорсодержащая руда смешивается в
заданных соотношениях с кремнезёмом и коксом и загружается в электропечь. Кремнезём необходим для снижения температуры реакции, а также увеличения ее скорости за счет связывания выделяющейся в процессе восстановления окиси кальция в силикат кальция, который непрерывно удаляется в виде расплавленного шлака. В шлак переходят также силикаты и окислы алюминия, магния, железа и др. примеси, а также феррофосфор (Fe2P, FeP, Fe3P), образующийся при взаимодействии части восстановленного железа с фосфором. Феррофосфор, а также растворённые в нём небольшие количества фосфидов марганца и др. металлов по мере накопления удаляются из электропечи с целью последующего использования при производстве специальных сталей. Пары фосфора выходят из электропечи вместе с газообразными побочными
продуктами и летучими примесями (CO, SiF4, PH3, пары воды, продукты пиролиза органических примесей шихты и др.) при температуре 250-350 °C. После очистки от пыли содержащие фосфор газы направляют в конденсационные установки, в которых при температуре не ниже 50 °C собирают под водой жидкий технический белый фосфор. Разрабатываются методы получения фосфора с применением газообразных
восстановителей, плазменных реакторов с целью интенсификации производства за счёт повышения температур до 2500-3000 °C, т. е. выше температур диссоциации природных фосфатов и газов-восстановителей (например, метана), используемых в качестве транспортирующего газа в низкотемпературной плазме.
Применение. Основная масса производимого фосфор перерабатывается в фосфорную кислоту и получаемые на её основе фосфорные удобрения и технические соли (фосфаты). Белый фосфор используется в зажигательных и дымовых снарядах, бомбах; красный
фосфор - в спичечном производстве. Фосфор применяется в производстве сплавов цветных металлов как раскислитель. Введение до 1% фосфора увеличивает жаропрочность таких сплавов, как фехраль, хромаль. Фосфор входит в состав некоторых бронз, т.к. повышает их жидкотекучесть и стойкость против истирания. Фосфиды металлов, а также некоторых неметаллов (В, Si, As и т.п.) используются при получении и легировании полупроводниковых материалов. Частично фосфор применяется для получения хлоридов и сульфидов, которые служат исходными веществами для производства фосфорсодержащих пластификаторов (например, трикрезилфосфат, трибутилфосфат и др.), медикаментов, фосфорорганических пестицидов, а также применяются в качестве добавок в смазочные вещества и в горючее. Техника безопасности. Белый фосфор и его соединения высокотоксичны. Работа с
фосфором требует тщательной герметизации аппаратуры; хранить белый фосфор. следует под водой или в герметически закрытой металлической таре. При работе с фосфором следует строго соблюдать правила техники безопасности. Фосфор в организме. Фосфор - один из важнейших биогенных элементов,
необходимый для жизнедеятельности всех организмов. Присутствует в живых клетках в виде орто- и пирофосфорной кислот и их производных, а также входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, фосфорных эфиров углеводов, многих коферментов и др. органических соединений. Благодаря особенностям химического строения атомы фосфора, подобно атомам серы, способны к образованию богатых энергией связей в макроэргических соединениях; аденозинтрифосфорной кислоте (АТФ), креатин фосфате и др.. В процессе биологической эволюции именно фосфорные соединения стали основными, универсальными хранителями генетической информации и переносчиками энергии во всех живых системах. Др. важная роль соединений фосфора в организме заключается в том, что ферментативное присоединение фосфорильного остатка () к различным органическим соединениям (фосфорилирование) служит как бы "пропуском" для их участия в обмене веществ, и, наоборот, отщепление фосфорильного остатка (дефосфорилирование) исключает эти соединения из активного обмена. Ферменты обмена фосфора - киназы, фосфорилазы и фосфатазы. Главную роль в превращениях соединений фосфора в организме животных и человека играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Содержание фосфора (в мг на 100 г сухого вещества) в тканях растений - 230-350,
морских животных - 400-1800, наземных - 1700-4400, у бактерий - около 3000; в организме человека особенно много фосфора в костной ткани (несколько более 5000), в тканях мозга (около 4000) и в мышцах (220-270). Суточная потребность человека в фосфоре 1-1,2 г (у детей она выше, чем у взрослых). Из продуктов питания наиболее богаты фосфором сыр, мясо, яйца, зерно бобовых культур (горох, фасоль и др.). Баланс фосфора в организме зависит от общего состояния обмена веществ. Нарушение фосфорного обмена приводит к глубоким биохимическим изменениям, в первую очередь в энергетическом обмене. При недостатке фосфора в организме у животных и человека развиваются остеопороз и др. заболевания костей, у растений - фосфорное голодание. Источником фосфора в живой природе служат его неорганические соединения, содержащиеся в почве и растворённые в воде. Из почвы фосфор извлекается растениями в виде растворимых фосфатов. Животные обычно получают достаточное количество фосфора с пищей. После гибели организмов фосфор вновь поступает в почву и донные отложения, участвуя т. о. в круговороте веществ. Важная роль фосфора в регуляции обменных процессов обусловливает высокую чувствительность многих ферментных систем живых клеток к действию фосфорорганических соединений. Это обстоятельство используют в медицине при разработке лечебных препаратов, в сельском хозяйстве при производстве фосфорных
удобрений, а также при создании эффективных инсектицидов. Многие соединения фосфор чрезвычайно токсичны и некоторые из фосфорорганических соединений могут быть причислены к боевым отравляющим веществам (зарин, зоман, табун). Радиоактивный изотоп фосфора 32P широко используют в биологии и медицине как индикатор при исследовании всех видов обмена веществ и энергии в живых организмах. Лекарственные препараты, содержащие фосфор (аденозинтрифосфорная кислота,
фитин, глицерофосфат кальция, фосфрен и др.), влияют главным образом на процессы тканевого обмена и применяются при заболеваниях мышц, нервной системы, при туберкулёзе, упадке питания, малокровии и др. Радиоактивные изотопы фосфора используют в качестве изотопных индикаторов для изучения обмена веществ, диагностики заболеваний, а также для лучевой терапии опухолей.
Мышьяк (лат. Arsenicum), As, химический элемент V группы периодической системы Менделеева, атомный номер 33, атомная масса 74,9216; кристаллы серо- стального цвета. Элемент состоит из одного устойчивого изотопа 75As. Историческая справка. Природные соединения мышьяк с серой (аурипигмент As2S3,
реальгар As4S4) были известны народам древнего мира, которые применяли эти минералы как лекарства и краски. Был известен и продукт обжигания сульфидов мышьяка - оксид мышьяка (III) As2O3 ("белый мышьяк"). Название arsenikón встречается уже у Аристотеля; оно произведено от греч. ársen - сильный, мужественный и служило для обозначения соединений мышьяк (по их сильному действию на организм). Русское название, как полагают, произошло от "мышь" (по применению препаратов мышьяка для истребления мышей и крыс). Получение мышьяка в свободном состоянии приписывают Альберту Великому (около 1250). В 1789 А. Лавуазье включил мышьяк в список химических элементов. Распространение в природе. Среднее содержание мышьяка в земной коре (кларк)
1,7·10-4% (по массе), в таких количествах он присутствует в большинстве изверженных пород. Поскольку соединения мышьяка летучи при высоких температурах, элемент не накапливается при магматических процессах; он концентрируется, осаждаясь из горячих глубинных вод (вместе с S, Se, Sb, Fe, Co, Ni, Cu и др. элементами). При извержении вулканов мышьяк в виде своих летучих соединений попадает в атмосферу. Так как мышьяк многовалентен, на его миграцию оказывает большое влияние окислительно- восстановительная среда. В окислительных условиях земной поверхности образуются арсенаты (As5+) и арсениты (As3+). Это редкие минералы, встречающиеся только на участках месторождений мышьяк. Ещё реже встречается самородный мышьяк и минералы As2+. Из многочисленных минералов мышьяка (около 180) основное промышленное значение имеет лишь арсенопирит FeAsS. Малые количества мышьяка необходимы для жизни. Однако в районах месторождении
мышьяка и деятельности молодых вулканов почвы местами содержат до 1% мышьяка, с чем связаны болезни скота, гибель растительности. Накопление мышьяка особенно характерно для ландшафтов степей и пустынь, в почвах которых мышьяк малоподвижен. Во влажном климате мышьяк легко вымывается из почв. В живом веществе в среднем 3·10-5% мышьяка, в реках 3·10-7%. Мышьяк, приносимый
реками в океан, сравнительно быстро осаждается. В морской воде лишь 1·10-7% мышьяк, но зато в глинах и сланцах 6,6·10-4%. Осадочные железные руды, железомарганцевые конкреции часто обогащены мышьяком.
Физические и химические свойства. Мышьяк имеет несколько аллотропических модификаций. При обычных условиях наиболее устойчив так называемый металлический, или серый, мышьяк (a-As) - серо-стальная хрупкая кристаллическая масса; в свежем изломе имеет металлический блеск, на воздухе быстро тускнеет, т. к. покрывается тонкой плёнкой As2O3. Кристаллическая решётка серого мышьяка ромбоэдрическая (а - 4,123 Å, угол a – 54о10", х - 0,226), слоистая. Плотность 5,72 г/см3 (при 20оC), удельное электрическое сопротивление 35·10-8 ом ×м , или 35·10-6 ом ×см , температурный коэффициент электросопротивления 3,9·10-3 (0о-100 оC), твёрдость по Бринеллю 1470 Мн/ м2 , или 147 кгс/мм2 (3-4 по Моосу); мышьяк диамагнитен. Под атмосферным давлением мышьяк возгоняется при 615 оC не плавясь, т. к. тройная точка (см. Диаграмма состояния) a-As лежит при 816 ?C и давлении 36 ат . Пар мышьяка состоит до 800 ?C из молекул As4, выше 1700 ?C - только из As2. При конденсации пара мышьяк на поверхности, охлаждаемой жидким воздухом, образуется жёлтый мышьяк - прозрачные, мягкие как воск кристаллы, плотностью 1,97 г/см3 , похожие по свойствам на белый фосфор. При действии света или при слабом нагревании он переходит в серый мышьяк. Известны также стекловидно-аморфные модификации: чёрный мышьяк и бурый мышьяк, которые при нагревании выше 270?C превращаются в серый М. Конфигурация внешних электронов атома мышьяка 3d 104s 24p 3. В соединениях мышьяк
имеет степени окисления + 5, + 3 и - 3. Серый мышьяк значительно менее активен химически, чем фосфор. При нагревании на воздухе выше 400оC мышьяк горит, образуя As2O3. С галогенами мышьяк соединяется непосредственно; при обычных условиях AsF5 - газ; AsF3, AsCl3, AsBr3 - бесцветные легко летучие жидкости; AsI3 и As2l4 - красные кристаллы. При нагревании мышьяк с серой получены сульфиды: оранжево-красный As4S4 и лимонно-жёлтый As2S3. Бледно-жёлтый сульфид As2S5 осаждается при пропускании H2S в охлаждаемый льдом раствор мышьяковой кислоты (или её солей) в дымящей соляной кислоте: 2H3AsO4 + 5H2S = As2S5 + 8H2O; около 500оC он разлагается на As2S3 и серу. Все сульфиды М. нерастворимы в воде и разбавленных кислотах. Сильные окислители (смеси HNO3 + HCl, HCl + KClO3) переводят их в смесь H3AsO4 и H2SO4. Сульфид As2S3 легко растворяется в сульфидах и полисульфидах аммония и щелочных металлов, образуя соли кислот - тиомышьяковистой H3AsS3 и тиомышьяковой H3AsS4. С кислородом мышьяк даёт окислы: оксид М. (III) As2O3 - мышьяковистый ангидрид и оксид М. (V) As2O5 - мышьяковый ангидрид. Первый из них образуется при действии кислорода на М. или его сульфиды, например 2As2S3 + 9O2 - 2As2O3 + 6SO2. Пары As2O3 конденсируются в бесцветную стекловидную массу, которая с течением времени становится непрозрачной вследствие образования мелких кристаллов кубической сингонии, плотность 3,865 г/см3 . Плотность пара отвечает формуле As4O6: выше 1800?C пар состоит из As2O3. В 100 г воды растворяется 2,1 г As2O3 (при 25оC). Оксид М. (III) - соединение амфотерное, с преобладанием кислотных свойств. Известны соли (арсениты), отвечающие кислотам ортомышьяковистой H3AsO3 и метамышьяковистой HAsO2; сами же кислоты не получены. В воде растворимы только арсениты щелочных металлов и аммония. As2O3 и арсениты обычно бывают восстановителями (например, As2O3 + 2I2 + 5H2O - 4HI + 2H3AsO4), но могут быть и окислителями (например, As2O3 + 3C - 2As + 3CO). Оксид мышьяка (V) получают нагреванием мышьяковой кислоты H3AsO4 (около
200оC). Он бесцветен, около 500оC разлагается на As2O3 и O2. Мышьяковую кислоту получают действием концентрированной HNO3 на As или As2O3. Соли мышьяковой кислоты (арсенаты) нерастворимы в воде, за исключением солей щелочных металлов и аммония. Известны соли, отвечающие кислотам ортомышьяковой H3AsO4, метамышьяковой HAsO3, и пиромышьяковой H4As2O7; последние две кислоты в свободном состоянии не получены. При сплавлении с металлами мышьяк по большей части образует соединения (арсениды).
Получение и применение. Мышьяк получают в промышленности нагреванием мышьякового колчедана:
FeAsS - FeS + As или (реже) восстановлением As2O3 углем. Оба процесса ведут в ретортах из
огнеупорной глины, соединённых с приёмником для конденсации паров мышьяка. Мышьяковистый ангидрид получают окислительным обжигом мышьяковых руд или как побочный продукт обжига полиметаллических руд, почти всегда содержащих мышьяк. При окислительном обжиге образуются пары As2O3, которые конденсируются в уловительных камерах. Сырой As2O3 очищают возгонкой при 500-600?C. Очищенный As2O3 служит для производства мышьяка и его препаратов.
Небольшие добавки мышьяк (0,2-1,0% по массе) вводят в свинец, служащий для производства ружейной дроби (мышьяк повышает поверхностное натяжение расплавленного свинца, благодаря чему дробь получает форму, близкую к сферической; мышьяк несколько увеличивает твёрдость свинца). Как частичный заменитель сурьмы мышьяк входит в состав некоторых баббитов и типографских сплавов. Чистый мышьяк не ядовит, но все его соединения, растворимые в воде или могущие
перейти в раствор под действием желудочного сока, чрезвычайно ядовиты; особенно опасен мышьяковистый водород. Из применяемых на производстве соединений мышьяк наиболее токсичен мышьяковистый ангидрид. Примесь мышьяка содержат почти все сульфидные руды цветных металлов, а также железный (серный) колчедан. Поэтому при их окислительном обжиге, наряду с сернистым ангидридом SO2, всегда образуется As2O3; большая часть его конденсируется в дымовых каналах, но при отсутствии или малой эффективности очистных сооружений отходящие газы рудообжигательных печей увлекают заметные количества As2O3. Чистый мышьяк, хотя и не ядовит, но при хранении на воздухе всегда покрывается налётом ядовитого As2O3. При отсутствии должной вентиляции крайне опасно травление металлов (железа, цинка) техническими серной или соляной кислотами, содержащими примесь мышьяка, т. к. при этом образуется мышьяковистый водород. Мышьяк в организме. В качестве микроэлемента мышьяк повсеместно распространён
в живой природе. Среднее содержание мышьяка в почвах 4·10-4%, в золе растений - 3·10-5%. Содержание мышьяка в морских организмах выше, чем в наземных (в рыбах 0,6-4,7 мг в 1 кг сырого вещества, накапливается в печени). Среднее содержание мышьяк в теле человека 0,08-0,2 мг/кг . В крови мышьяк концентрируется в эритроцитах, где он связывается с молекулой гемоглобина (причём в глобиновой фракции содержится его вдвое больше, чем в геме). Наибольшее количество его (на 1 г ткани) обнаруживается в почках и печени. Много мышьяка содержится в лёгких и селезёнке, коже и волосах; сравнительно мало - в спинномозговой жидкости, головном мозге (главным образом гипофизе), половых железах и др. В тканях мышьяк находится в основной белковой фракции, значительно меньше - в кислоторастворимой и лишь незначительная часть его обнаруживается в липидной фракции. Мышьяк участвует в окислительно- восстановительных реакциях: окислительном распаде сложных углеводов, брожении, гликолизе и т. п. Соединения мышьяка применяют в биохимии как специфические ингибиторы ферментов для изучения реакций обмена веществ. Мышьяк в медицине. Органические соединения мышьяка (аминарсон, миарсенол,
новарсенал, осарсол) применяют, главным образом, для лечения сифилиса и протозойных заболеваний. Неорганические препараты мышьяка - натрия арсенит (мышьяковокислый натрий), калия арсенит (мышьяковистокислый калий), мышьяковистый ангидрид As2O3, назначают как общеукрепляющие и тонизирующие средства. При местном применении неорганические препараты мышьяка могут вызывать некротизирующий эффект без предшествующего раздражения, отчего этот процесс протекает почти безболезненно; это свойство, которое наиболее выражено у As2O3, используют в стоматологии для
разрушения пульпы зуба. Неорганические препараты мышьяка применяют также для лечения псориаза. Полученные искусственно радиоактивные изотопы М. 74As (T1/2 - 17,5 сут ) и 76As (T1/2
26,8 ч ) используют в диагностических и лечебных целях. С их помощью уточняют локализацию опухолей мозга и определяют степень радикальности их удаления. Радиоактивный мышьяк используют иногда при болезнях крови и др. Согласно рекомендациям Международной комиссии по защите от излучений,
предельно допустимое содержание 76As в организме 11 мккюри . По санитарным нормам, принятым в СССР, предельно допустимые концентрации 76As в воде и открытых водоёмах 1·10-7 кюри/л , в воздухе рабочих помещений 5·10-11 кюри/л . Все препараты мышьяка очень ядовиты. При остром отравлении ими наблюдаются сильные боли в животе, понос, поражение почек; возможны коллапс, судороги. При хроническом отравлении наиболее часты желудочно-кишечные расстройства, катары слизистых оболочек дыхательных путей (фарингит, ларингит, бронхит), поражения кожи (экзантема, меланоз, гиперкератоз), нарушения чувствительности; возможно развитие апластической анемии. При лечении отравлений препаратами мышьяка наибольшее значение придают унитиолу. Меры предупреждения производственных отравлений должны быть направлены
прежде всего на механизацию, герметизацию и обеспыливание технологического процесса, на создание эффективной вентиляции и обеспечение рабочих средствами индивидуальной защиты от воздействия пыли. Необходимы регулярные медицинские осмотры работающих. Предварительные медицинские осмотры производят при приёме на работу, а для работающих - раз в полгода.
СУРЬМА (лат. Stibium), Sb, химический элемент V группы периодической системы Менделеева; атомный номер 51, атомная масса 121,75; металл серебристо-белого цвета с синеватым оттенком. В природе известны два стабильных изотопа 121Sb (57,25%) и 123Sb (42,75%). Из искусственно полученных радиоактивных изотопов важнейшие 122Sb (Т 1/2 - 2,8 cym ), 124Sb (T 1/2 - 60,2 cym ) и 125Sb (T 1/2 - 2 года).
Историческая справка. Сурьма известна с глубокой древности. В странах Востока она употреблялась примерно за 3000 лет до н. э. для изготовления сосудов. В Древнем Египте уже в 19 в. до н. э. порошок сурьмяного блеска (природный Sb2S3) под названием mesten или stem применялся для чернения бровей. В Древней Греции он был известен как stími и stíbi, отсюда латинский stibium. Около 12-14 вв. н. э. появилось название antimonium. В 1789 А. Лавуазье включил сурьму в список химических элементов под названием antimoine (современный английский antimony, испанский и итальянский antimonio, немецкий Antimon). Русская "сурьма" произошло от турецкого sürme; им обозначался порошок свинцового блеска PbS, также служивший для чернения бровей (по другим данным, "сурьма" - от персидского сурме - металл). Подробное описание свойств и способов получения сурьмы и её соединений впервые дано алхимиком Василием Валентином (Германия) в 1604. Распространение в природе. Среднее содержание сурьмы в земной коре (кларк) 5 ×10-5
% по массе. В магме и биосфере сурьма рассеяна. Из горячих подземных вод она концентрируется в гидротермальных месторождениях. Известны собственно сурьмяные месторождения, а также сурьмяно-ртутные, сурьмяно-свинцовые, золото-сурьмяные, сурьмяно-вольфрамовые. Из 27 минералов сурьмы главное промышленное значение имеет антимонит (Sb2S3). Благодаря сродству с серой сурьма в виде примеси часто встречается в сульфидах мышьяка, висмута, никеля, свинца, ртути, серебра и других элементов. Физические и химические свойства. Сурьма известна в кристаллической и трёх
аморфных формах (взрывчатая, чёрная и жёлтая). Взрывчатая сурьма (плотность 5,64-5,97 г/см 3) взрывается при любом соприкосновении: образуется при электролизе раствора
SbCl3; чёрная (плотность 5,3 г/см 3) - при быстром охлаждении паров сурьмы; жёлтая - при пропускании кислорода в сжиженный SbH3. Жёлтая и чёрная сурьма неустойчивы, при пониженных температурах переходят в обыкновенную сурьму. Наиболее устойчивая кристаллическая сурьма, кристаллизуется в тригональной системе, а - 4,5064 ; плотность 6,61-6,73 г/см 3(жидкой - 6,55 г/см 3); t пл 630,5 °C; t кип1635-1645 °C; удельная теплоёмкость при 20-100 °C 0,210 кдж/(кг × К) ; теплопроводность при 20 °C 17,6 вт/м × К .Температурный коэффициент линейного расширения для поликристаллической С. 11,5 ×10-6 при 0-100 °C; для монокристалла a1 - 8,1×10-a2 - 19,5×10-6 при 0-400 °C, удельное электросопротивление (20 °C) (43,045×10-6 ом ×см ). Сурьма диамагнитна, удельная магнитная восприимчивость -0,66 ×10-6. В отличие от большинства металлов, сурьма хрупка, легко раскалывается по плоскостям спайности, истирается в порошок и не поддаётся ковке (иногда её относят к полуметаллам). Механические свойства зависят от чистоты металла. Твёрдость по Бринеллю для литого металла 325-340 Мн/м 2 (32,5-34,0 кгс/мм 2); модуль упругости 285-300; предел прочности 86,0 Мн/м 2 (8,6 кгс/мм 2). Конфигурация внешних электронов атома Sb5s25r3. В соединениях проявляет степени окисления главным образом +5, +3 и -3. В химическом отношении сурьма малоактивна. На воздухе не окисляется вплоть до
температуры плавления. Сурьма азотом и водородом не реагирует. Углерод незначительно растворяется в расплавленной сурьмой. Металл активно взаимодействует с хлором и др. галогенами, образуя сурьмы галогениды. С кислородом взаимодействует при температуре выше 630 °C с образованием Sb2O3. При сплавлении с серой получаются сурьмы сульфиды, так же взаимодействует с фосфором и мышьяком. Сурьма устойчива по отношению к воде и разбавленным кислотам. Концентрированные соляная и серная кислоты медленно растворяют сурьма с образованием хлорида SbCl3 и сульфата Sb2 (SO4)3; концентрированная азотная кислота окисляет сурьму до высшего окисла, образующегося в виде гидратированного соединения xSb2O5 ×уН2О. Практический интерес представляют труднорастворимые соли сурьмяной кислоты - антимонаты(МеSbO3 ×3H2O, где Me - Na, К) и соли не выделенной метасурьмянистой кислоты - метаантимониты (MeSbO2 ×ЗН2О), обладающие восстановительными свойствами. С. соединяется с металлами, образуя антимониды. Получение. Сурьма получают пирометаллургической и гидрометаллургической
переработкой концентратов или руды, содержащей 20-60% Sb. К пирометаллургическим методам относятся осадительная и восстановительная плавки. Сырьём для осадительной плавки служат сульфидные концентраты; процесс основан на вытеснении сурьмы из её сульфида железом: Sb2S3 + 3Fe Û 2Sb + 3FeS. Железо вводится в шихту в виде скрапа. Плавку ведут в отражательных или в коротких вращающихся барабанных печах при 1300-1400 °C. Извлечение сурьмы в черновой металл составляет более 90%. Восстановительная плавка сурьмы основана на восстановлении её окислов до металла древесным углем или каменноугольной пылью и ошлаковании пустой породы. Восстановительной плавке предшествует окислительный обжиг при 550 °C с избытком воздуха. Огарок содержит нелетучую четырёхокись сурьмы. Как для осадительной, так и для восстановительной плавок возможно применение электропечей. Гидрометаллургический способ получения сурьмы состоит из двух стадий: обработки сырья щелочным сульфидным раствором с переводом сурьмы в раствор в виде солей сурьмяных кислот и сульфосолей и выделения сурьмы. электролизом. Черновая сурьма в зависимости от состава сырья и способа её получения содержит от 1,5 до 15% примесей: Fe, As, S и др. Для получения чистой сурьмы применяют пирометаллургическое или электролитическое рафинирование. При пирометаллургическом рафинировании примеси железа и меди удаляют в виде сернистых соединений, вводя в расплав сурьмы антимонит (крудум) - Sb2S3, после чего удаляют мышьяк (в виде арсената натрия) и серу при продувке воздуха под содовым шлаком. При электролитическом рафинировании с растворимым анодом черновую сурьму очищают от железа, меди и др. металлов, остающихся в
электролите (Си, Ag, Аи остаются в шламе). Электролитом служит раствор, состоящий из SbF3, H2SO4 и HF. Содержание примесей в рафинированной сурьме не превышает 0,5-0,8%. Для получения сурьмы высокой чистоты применяют зонную плавку в атмосфере инертного газа или получают сурьму из предварительно очищенных соединений - трёхокиси или трихлорида. Применение. Сурьма применяется в основном в виде сплавов на основе свинца и олова
для аккумуляторных пластин, кабельных оболочек, подшипников (баббит), сплавов, применяемых в полиграфии (гарт), и т. д. Такие сплавы обладают повышенной твёрдостью, износоустойчивостью, коррозионной стойкостью. В люминесцентных лампах галофосфатом кальция активируют Sb. Сурьма входит в состав полупроводниковых материалов как легирующая добавка к германию и кремнию, а также в состав антимонидов (например, InSb). Радиоактивный изотоп 12Sb применяется в источниках g- излучения и нейтронов. Сурьма в организме. Содержание сурьмы (на 100 г сухого вещества) составляет в
растениях 0,006 мг, в морских животных 0,02 мг, в наземных животных 0,0006 мг. В организм животных и человека сурьма поступает через органы дыхания или желудочно- кишечный тракт. Выделяется главным образом с фекалиями, в незначительном количестве - с мочой. Биологическая роль сурьма неизвестна. Она избирательно концентрируется в щитовидной железе, печени, селезёнке. В эритроцитах накапливается преимущественно сурьмы в степени окисления + 3, в плазме крови - в степени окисления + 5. Предельно допустимая концентрация С. 10-5 - 10-7 г на 100 г сухой ткани. При более высокой концентрации этот элемент инактивирует ряд ферментов липидного, углеводного и белкового обмена (возможно в результате блокирования сульфгидрильных групп). В медицинской практике препараты сурьмы (солюсурьмин и др.) используют в
основном для лечения лейшманиоза и некоторых гельминтозов (например, шистосоматоза). Сурьма и её соединения ядовиты. Отравления возможны при выплавке концентрата
сурьмяных руд и в производстве сплавов сурьмы. При острых отравлениях - раздражение слизистых оболочек верхних дыхательных путей, глаз, а также кожи. Могут развиться дерматит, конъюнктивит и т. д. Лечение: антидоты (унитиол), мочегонные и потогонные средства и др. Профилактика: механизация производств. процессов, эффективная вентиляция и т. д.
ВИСМУТ (лат. Bismuthum), Bi, химический элемент V группы периодической
системы Менделеева; атомный номер 83, атомная масса 208,980; серебристо-серый металл с розоватым оттенком. Природный висмут состоит из одного стабильного изотопа 209Bi. В. был известен в 15-16 вв., но долгое время его считали разновидностью олова,
свинца или сурьмы. За самостоятельный металл висмут был признан в середине 18 в. Французский химик А. Лавуазье включил его в список простых тел. Происхождение названия " висмут" не установлено. Содержание висмута в земной коре 2·10-5% по массе. Висмут встречается в природе в
виде многочисленных минералов, из которых главнейшие - висмутовый блеск Вi2S3, висмут самородный Bi, бисмит Bi2O3 и др.. В большем количестве, но в малых концентрациях висмут встречается как изоморфная примесь в свинцово-цинковых, медных, молибденово-кобальтовых и олово-вольфрамовых рудах. Около 90% мирового потребления покрывается попутной добычей висмута при переработке полиметаллических руд. Физические и химические свойства. Висмут имеет ромбоэдрическую решётку с
периодом a - 4,7457 А и углом α-57?14" 13"" . Плотность 9,80 г/см 3; t пл 271,3°C; t kип 1560 °C. Удельная теплоёмкость (20 °C) 123,5 дж/кг ·К (0,0294 кал/г ·С); термический коэффициент
линейного расширения при комнатной температуре 13,3·10-6; удельная теплопроводность (20°C) 8,37 вт/(м ·К) ; удельное электрическое сопротивление (20оС) 106,8·10-8 ом ·м (106,8·10-6 ом ·см ). Висмут - самый диамагнитный металл. Удельная магнитная восприимчивость равна -1,35·10-6. Под влиянием магнитного поля электросопротивление висмут увеличивается в большей степени, чем у других металлов, что используется для измерения индукции сильных магнитных полей. Сечение захвата тепловых нейтронов у висмута мало (34·10-31 м 2 или 0,034 барна). При комнатной температуре висмут хрупок, легко раскалывается по плоскостям спайности, в фарфоровой ступке растирается в порошок. При температуре 120-150°C ковок; горячим прессованием (при 240-250оС) из него можно изготовить проволоку диаметром до 0,1 мм , а также пластинки толщиной 0,2-0,3 мм . Твёрдость по Бринеллю 93 Мн/м 2 (9,3 кгс/мм 2), по Моосу 2,5. При плавлении В. уменьшается в объёме на 3,27%. Висмут в сухом воздухе устойчив, во влажном наблюдается его поверхностное
окисление. При нагревании выше 1000°C сгорает голубоватым пламенем с образованием окиси Bi2O3. В ряду напряжений висмут стоит между водородом и медью, поэтому в разбавленной серной и соляной кислотах не растворяется; растворение в концентрированных серной и азотной кислотах идёт с выделением SO2 и соответствующих окислов азота. Висмут проявляет валентность 2, 3 и 5. Соединения висмута низших валентностей
имеют основной характер, высших - кислотный. Из кислородных соединений В. наибольшее значение имеет трёхокись Вi2O3, при нагревании меняющая свой жёлтый цвет на красно-коричневый. Вi2O3 применяют для получения висмутовых солей. В разбавленных растворах висмутовые соли гидролизуются. Хлорид BiCl3 гидролизуется с выпадением хлорокиси BiOCl, нитрат Bi (NO3)3 - с выпадением основной соли BiONO3·BiOOH. Способность солей В. гидролизоваться используется для его очистки. Соединения 5-валентного висмута получаются с трудом; они являются сильными окислителями. Соль КВiО3 (соответствующая ангидриду Bi2O5) образуется в виде буро- красного осадка на платиновом аноде при электролизе кипящего раствора смеси KOH, KCl и взвеси Вi2O3. Висмут легко соединяется с галогенами и серой. При действии кислот на сплав висмута с магнием образуется висмутин (висмутистый водород) ВiH3; в отличие от арсина AsH3, висмутин - соединение неустойчивое и в чистом виде (без избытка водорода) не получено. С некоторыми металлами (свинцом, кадмием, оловом) висмут образует легкоплавкие эвтектики; с натрием, калием, магнием и кальцием - интерметаллические соединения c температурой плавления, значительно превышающей температуры плавления исходных компонентов. С расплавами алюминия, хрома и железа висмут не взаимодействует. Получение и применение. Основное количество висмут добывается попутно при
огневом рафинировании чернового свинца (веркблея). Пирометаллургический способ основан на способности висмута образовывать тугоплавкие интерметаллические соединения с К, Na, Mg и Ca. В расплавленный свинец добавляют указанные металлы и образовавшиеся твёрдые соединения их с В. (дроссы) отделяют от расплава. Значительное количество висмута извлекают из шламов электролитического рафинирования свинца в кремнефтористоводородном растворе, а также из пылей и шламов медного производства. Содержащие висмут дроссы и шламы сплавляют под щелочными шлаками. Полученный черновой металл содержит примеси As, Sb, Cu, Pb, Zn, Se, Te, Ag и некоторых других элементов. Выплавка висмута из собственных руд производится в небольшом масштабе. Сульфидные руды перерабатывают осадительной плавкой с железным скрапом. Из окисленных руд В. восстанавливают углём под слоем легкоплавкого флюса. Для грубой очистки чернового В. применяются в зависимости от состава примесей
различные методы: зейгерование, окислительное рафинирование под щелочными флюсами, сплавление с серой и др. Наиболее трудно отделяемая примесь свинца удаляется (до 0,01%) продуванием через расплавленный металл хлора. Товарный висмут содержит
99,9-99,98% основного металла. В. высокой чистоты получают зонной перекристаллизацией в кварцевых лодочках в атмосфере инертного газа. Значительное количество висмута идёт для приготовления легкоплавких сплавов, содержащих свинец, олово, кадмий, которые применяют в зубоврачебном протезировании, для изготовления клише с деревянных матриц, в качестве выплавляемых пробок в автоматических противопожарных устройствах, при напайке колпаков на бронебойные снаряды и т.д. Расплавленный висмут может служить теплоносителем в ядерных реакторах. Быстро увеличивается потребление висмута в соединениях с Te для
термоэлектрогенераторов. Эти соединения из-за благоприятного сочетания величин теплопроводности, электропроводности и термоэлектродвижущей силы позволяют преобразовывать тепловую энергию в электрическую с большим кпд (~7%). Добавка висмута к нержавеющим сталям улучшает их обрабатываемость резанием. Соединения висмута применяются в стекловарении, керамике, фармацевтической
промышленности. Растворимые соли висмута ядовиты, по характеру воздействия аналогичны ртути.
Литература
1. Вредные вещества в промышленности, под общ. ред. Н. В. Лазарева, 6 изд., ч. 2, Л., 1971.
2. Иванов В.В. Экологическая геохимия элементов. 3. Исследование в области создания новой технологии производства сурьмы и ее
соединений, в сборнике: Химия и технология сурьмы, Фр., 1965. 4. Краткая химическая энциклопедия, т. 5, М., 1967; 5. Некрасов Б. В., Основы общей химии, т. 1, М., 1965; 6. Погодин С. А., Мышьяк, в кн.: Краткая химическая энциклопедия, т. 3, М., 1964 7. Реми Г., Курс неорганической химии, пер. с нем., т. 1, М., 1963, с. 700-712; 8. Томсон Дж. Г., Висмут, пер. [с англ.], Л., 1932; 9. Шиянов А. Г., Производство сурьмы, М., 1961; Основы металлургии, т. 5, М.,
1968; 10. Химия и технология связанного азота, [М.- Л.], 1934; КХЭ, т. 1, М.,1961.
Подгруппу азота составляют пять элементов: азот, фосфор, мышьяк, сурьма и висмут. Это р-элементы V группы периодической системы Д. И. Менделеева.
На наружном энергетическом уровне атомы этих элементов содержат пять электронов, которые имеют конфигурацию ns2np3 и распределены следующим образом:

Поэтому высшая степень окисления этих элементов +5, низшая -3, характерна и +3.
Наличие трех неспаренных электронов на наружном уровне говорит о том, что в невозбужденном состоянии атомы элементов имеют валентность 3. Наружный уровень атома азота состоит только из двух подуровней - 2s и 2р. У атомов же остальных элементов этой подгруппы на наружных энергетических уровнях имеются вакантные ячейки d-подуровня. Следовательно, один из s-электронов наружного уровня может при возбуждении перейти на d-подуровень того же уровня, что приводит к образованию 5 неспаренных электронов.

внешняя электронная оболочка фосфора (невозбужденный атом)

внешняя электронная оболочка возбужденного атома фосфора.
Таким образом, фосфор, мышьяк, сурьма и висмут в возбужденном состоянии имеют 5 неспаренных электронов, и валентность их в этом состоянии равна 5.
В атоме азота возбудить электрон подобным образом нельзя вследствие отсутствия d-подуровня на втором уровне. Следовательно, пятивалентным азот быть не может, однако он может образовать четвертую ковалентную связь по донорно-акцепторному механизму за счет неподеленной электронной пары 2s2. Для атома азота возможен и другой процесс. При отрыве одного из двух 2s-электронов азот переходит в однозарядный четырехвалентный ион N+.

От азота к висмуту радиусы атомов увеличиваются, а ионизационные потенциалы уменьшаются. Восстановительные свойства нейтральных атомов усиливаются от N к Bi, а окислительные ослабевают (см. табл. 21).
С водородом азот, фосфор и мышьяк образуют полярные соединения RH3, проявляя отрицательную степень окисления -3. Молекулы RH3 имеют пирамидальную форму. В этих соединениях связи элементов с водородом более прочные, чем в соответствующих соединениях элементов подгруппы кислорода и особенно подгруппы галогенов. Поэтому водородные соединения элементов подгруппы азота в водных растворах не образуют ионов водорода.

С кислородом элементы подгруппы азота образуют оксиды общей формулы R2O3 и R2O5. Оксидам соответствуют кислоты HRO2 и HRO3 (и ортокислоты H3RO4, кроме азота). В пределах подгруппы характер оксидов изменяется так: N2O3 - кислотный оксид; Р4О6 - слабокислотный оксид; As2O3 - амфотерный оксид с преобладанием кислотных свойств; Sb2O3 - амфотерный оксид с преобладанием основных свойств; Bi2O3 - основной оксид. Таким образом, кислотные свойства оксидов состава R2O3 и R2O5 уменьшаются с ростом порядкового номера элемента.
Как видно из табл. 21, внутри подгруппы от азота к висмуту убывают неметаллические свойства и возрастают металлические. У сурьмы эти свойства выражены одинаково, у висмута преобладают металлические, у азота - неметаллические свойства. Фосфор, мышьяк и сурьма образуют несколько аллотропных соединения.
Азот.
Получение
В лабораториях его можно получать по реакции разложения нитрита аммония:
Реакция экзотермическая, идёт с выделением 80 ккал (335 кДж), поэтому требуется охлаждение сосуда при её протекании (хотя для начала реакции требуется нагревание нитрита аммония).
Практически эту реакцию выполняют, добавляя по каплям насыщенный раствор нитрита натрия в нагретый насыщенный раствор сульфата аммония, при этом образующийся в результате обменной реакции нитрит аммония мгновенно разлагается.
Выделяющийся при этом газ загрязнён аммиаком, оксидом азота (I) и кислородом, от которых его очищают, последовательно пропуская через растворы серной кислоты, сульфата железа (II) и над раскалённой медью. Затем азот осушают.
Ещё один лабораторный способ получения азота - нагревание смеси дихромата калия и сульфата аммония (в соотношении 2:1 по массе). Реакция идёт по уравнениям:
Наиболее чистый азот можно получить разложением азидов металлов:
Так называемый «воздушный», или «атмосферный» азот, то есть смесь азота с благородными газами, получают путём реакции воздуха с раскалённым коксом, при этом образуется так называемый «генераторный», или «воздушный», газ - сырьё для химических синтезов и топливо. При необходимости из него можно выделить азот, поглотив монооксид углерода.
Молекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха. Этим методом можно получить и «атмосферный азот». Также широко применяются азотные установки и станции, в которых используется метод адсорбционного и мембранного газоразделения.
Один из лабораторных способов - пропускание аммиака над оксидом меди (II) при температуре ~700 °C:
Аммиак берут из его насыщенного раствора при нагревании. Количество CuO в 2 раза больше расчётного. Непосредственно перед применением азот очищают от примеси кислорода и аммиака пропусканием над медью и её оксидом (II) (тоже ~700 °C), затем сушат концентрированной серной кислотой и сухой щёлочью. Процесс происходит довольно медленно, но он того стоит: газ получается весьма чистый.
На рис. 15.12 показано расположение в периодической таблице пяти элементов V группы. Все они являются p-элементами, и для внешней оболочки их атомов характерна электронная конфигурация . В табл. 15.10 указаны некоторые свойства элементов V группы. При перемещении к нижней части этой группы свойства ее элементов изменяются от неметаллических к металлическим. Азот и фосфор являются типичными неметаллами. Мышьяк и сурьма обнаруживают признаки металлического характера, а висмут представляет собой металл.
АЗОТ И ФОСФОР
Это два самых важных элемента в V группе.
При нормальных условиях азот представляет собой газ, состоящий из двухатомных

Рис. 15.12. Положение элементов V группы в периодической таблице.
Таблица 15.10. Свойства элементов V группы

молекул . Он не имеет цвета, запаха и вкуса и не обладает заметной реакционной способностью.
Фосфор существует в трех аллотропных формах, из которых наиболее распространены две - красный фосфор и менее устойчивый белый фосфор. Структура этих аллотропов обсуждалась в разд. 3.2. В табл. 15.11 сопоставляются некоторые свойства красного и белого фосфора.
Хотя азот - один из наиболее электроотрицательных элементов (см. табл. 2.2), он обладает сравнительно низкой реакпионной способностью. Причина заключается в том, что его двухатомные молекулы неполярны, а тройная связь между двумя атомами
Таблица 15.11. Свойства белого и красного фосфора


Рис. 15.13. Четыре -гибридные орбитали атома азота.
азота в них обладает очень высокой прочностью. Энтальпия этой связи равна + 944 кДж/моль.
Как азот, так и фосфор могут входить в свои соединения со степенями окисления от -3 до 4-5. Например, в аммиаке азот имеет степень окисления +3, а в нитрат-ионе его степень окисления равна -1-5.
Атомы обоих этих элементов способны присоединять по три электрона, что приводит к заполнению их внешней -подоболочки; в результате образуются нитрид-ионы и фосфид-ионы Однако оба элемента проявляют тенденцию к образованию ковалентных соединений. При этом их атомы образуют по четыре гибридные -орбитали, имеющие тетраэдрическую ориентацию (рис. 15.13). На трех из этих орбиталей находится по одному электрону. Именно эти электроны обобществляются при образовании ковалентных связей с электронами других атомов. На четвертой -орбитали находится неподеленная пара электронов. Она может использоваться для образования координационной (донорно-акцепторной) связи. Например, в ионе аммония неподеленная пара азота перекрывается с вакантной -орбиталью иона водорода.
ns 2 np 3 .
АЗОТ и его соединения
В природе встречается в свободном виде (содержание в воздухе – 78 объемных %), в виде минералов (селитры), в нефти, в растительных и животных белках.
Физические свойства
При обычных условиях N 2 – газ без цвета, запаха и вкуса,
t o кип. = -195,8 о С.
Получение азота:
а) в промышленности – сжижением воздуха,
б) в лаборатории: NH 4 NO 2 ® N 2 + Н 2 О.
Химические свойства азота и его соединений.
Химическая активность молекулярного азота очень мала, т.к. благодаря тройной ковалентной связи молекула очень прочная (Е связи = 946 кДж/моль). Однако известно много различных соединений для азота, в которых он проявляет степени окисления -3, -2, -1, +1, +2, +3, +4, +5.
Соединения азота с отрицательными степенями окисления.
3
1)NH 3 – аммиак – бесцветный газ с резким запахом, легко сжижается.
Получение аммиака:
а) N 2 + 3H 2 « 2NH 3 (Kat: Fe, Al 2 O 3 , K 2 O)
б) 2NH 4 CI + Ca(OH) 2 = CaCI 2 + 2NH 3 + 2H 2 O
Химические свойства аммиака:
а) NH 3 + H 2 O « NH 4 OH (максимальная концентрация = 25%)
б) NH 3 + HCI « NH 4 CI (дон.-акц. механизм: NH 3 + Н + = NH 4 +)
в)горение в зависимости от количества кислорода идет по-разному:
4NH 3 + 3О 2(нед.) = 2N 2 + 6H 2 O
4NH 3 + 5О 2(изб.) = 2NО+ 6H 2 O
г) в ОВР аммиак всегда восстановитель:
3CuO + 2NH 3 = 3Cu + N 2 + 3H 2 O
2) NH 4 OH – гидроксид аммония - слабое основание, неустойчивое, хорошо образует комплексные соединения (аммиакаты):
Cu(OH) 2 + 4NH 4 OH = (OH) 2 + 4H 2 O
3) Соли аммония:
а) растворы вследствие гидролиза имеют слабокислую реакцию:
NH 4 CI + НОН « NH 4 ОН+ НCI (NH 4 + + НОН « NH 4 ОН + Н +)
б) термическое разложение солей аммония идет по-разному в зависимости от природы аниона: если анион – окислитель, то реакция разложения идет необратимо:
NH 4 CI « NH 3 + HCI
NH 4 NO 3 = N 2 О+ 2H 2 O
4) Амиды образуются при замещении атомов Н в аммиаке на металл:
2К + 2NH 3 = 2КNH 2 + H 2
5) Нитриды известны для металлов и неметаллов и в зависимости от природы по-разному разлагаются:
а)Li 3 N + 3H 2 O = 3LiOH + NH 3
Ca 3 N 2 + 6HCI = 3CaCI 2 + 2NH 3
б)CI 3 N + 6HCI = 3HCIO + NH 3
Степень окисления –2
N 2 Н 4 – гидразин (диамид) – бесцветная жидкость, хороший растворитель, менее устойчив, чем аммиак.
Получение гидразина:
2NH 3 + NaCIO = N 2 Н 4 + NaCI + H 2 O
Химические свойства гидразина:
N 2 Н 4 + H 2 O « + +OH -
H 2 O « 2+ +OH -
б) Сгорает до азота: N 2 Н 4 + O 2 = N 2 + 2H 2 O
в) Сильный восстановитель: N 2 Н 4 + 2H 2 O 2 = N 2 + 4H 2 O
Степень окисления –1
NH 2 OH – гидроксиламин , белое кристаллическое вещество, занимает промежуточное положение между H 2 O 2 и гидразином N 2 Н 4.
Получение гидроксиламина:
HNO 3 + 6Н = NН 2 ОН + 2H 2 O
Химические свойства гидроксиламина:
а) Водные растворы – слабые основания:
NН 2 ОН + H 2 O « + +OH -
б) С кислотами дают соли гидроксиламмония (устойчивые):
NН 2 ОН + HCI = + + CI -
в) Разлагается (реакция диспропорционирования):
3NН 2 ОН = NН 3 + N 2 + 3H 2 O
г) Как и H 2 O 2 , в зависимости от среды проявляет окислительно - восстановительную двойственность:
ок-ль: 2NН 2 ОН + 4FeSO 4 + 3H 2 SO 4 = 2Fe 2 (SO 4) 3 + (NH 4) 2 SO 4 + 2H 2 O
восст-ль: 2NН 2 ОН + I 2 + 2KOH = N 2 + 2KI + 4H 2 O
Наиболее важныесоединения азота с положительными с. о.
Степень окисления +3
1) N 2 О 3 - оксид азота (III) или «азотистый ангидрид» - неустойчивая сине-зеленая жидкость:
а) N 2 О 3 ® NО 2(бурый газ с резким запахом) + NО (бесцветный газ) ;
б) с водой образует неустойчивую кислоту: N 2 О 3 + H 2 O « 2 HNO 2
2) HNO 2 – азотистая кислота (средней силы):
HNO 2 « H + + NO 2 - (К = 5,1 . 10 -4).
3) Нитриты – соли азотистой кислоты, как и другие соединения N +3 в окислительно-восстановительных реакциях, проявляют двойственность:
ок-ль: КNO 2 + NH 3 = N 2 + H 2 O
восст-ль: КNO 2 + H 2 O 2 = КNO 3 + H 2 O
Максимальная степень окисления +5
1) N 2 О 5 - оксид азота (V) или «азотный ангидрид» - бесцветное кристаллическое вещество; при растворении в воде дает кислоту.
2) HNO 3 – азотная кислота, сильная: HNO 3 ® H + + NO 3 - .
3) Нитраты – соли азотной кислоты:
а) в лаборатории можно получать N 2 О по реакции термического разложения: NH 4 NO 3 ® N 2 О + Н 2 О;
б) нитраты металлов в зависимости от положения металла в ряду активности разлагаются по-разному:
левее Mg: нитрат ® нитрит + O 2
Mg – Cu: нитрат ® оксид металла + NO 2 + O 2
правее Cu: нитрат ® металл + NO 2 + O 2 .
4)все соединения N +5 сильные окислители; взаимодействие азотной кислоты с металлами:
а) ни один металл не выделяет из HNO 3 водород;
б) при обычной t o пассивируются металлы Al, Zn, Cr, Fe, Pb, Au, Pt;
в) при нагревании c большинством металлов взаимодействует, причем чем активнее металл и разбавленнее кислота, тем сильнее восст-ся N +5:
неакт. Ме : Cu + 4HNO 3(конц.) = Cu(NO 3) 2 + 2NO 2 + 2H 2 O
3Cu + 8HNO 3(разб.) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
актив. Ме : 4Cа + 10HNO 3(конц.) = 4Cа(NO 3) 2 + N 2 О + 5H 2 O
5Cа + 12HNO 3(разб.) = 5Cа(NO 3) 2 + N 2 + 6H 2 O
4Cа + 9HNO 3 (оч. разб.) = 4Cа(NO 3) 2 + NН 3 (или NH 4 NO 3)+ 3H 2 O
ФОСФОР и его соединения
В природе встречается: а)в виде минералов (фосфориты и апатиты), б)в растительных и животных белках, в)в тканях мозга и костях.
Физические свойства
Аллотропен:
а) белый фосфор (Р 4) – тетраэдрическое строение, ядовит, светится в темноте, растворим в сероуглероде; при хранении постепенно переходит в красный фосфор, поэтому его хранят под водой;
б) красный фосфор (Р 2 n – полимер) – существует несколько форм строения, не ядовит, нерастворим в сероуглероде, устойчив при хранении, менее реакционоспособен;
в) черный фосфор – пирамидальное строение, слоистый, похож на графит, полупроводник.
Получение фосфора:
Минерал «фосфорит» прокаливают с коксом и песком:
Са 3 (РО 4) + 5С + 3 SiО 2 = 3СаSiО 3 +2Р +5СО
Химические свойства фосфора и его соединений.
Химическая активность фосфора различна в зависимости от его аллотропной модификации. Основные степени окисления: -3, +1, +3, +5.
1) Реакции фосфора с простыми веществами:
восстановительные свойства: a)Р + О 2 ® Р 2 О 3 , Р 2 О 5 ;
б)Р + СI 2 ® РCI 3 , РCI 5 ; в) 2Р + 3S ® Р 2 S 3
окислительные свойства: а)2Р + 3Н 2 ® 2РН 3 , б)2Р + 3Са ® Са 3 Р 2
2) Реакции фосфора со сложными веществами:
а) реакция с водой не идет,
б) 2Р + 5H 2 SO 4(конц.) ® 2H 3 РO 4 + 5SO 2 + 2H 2 O,
в) Р + HNO 3(конц.) ® H 3 РO 4 + NO (или NO 2).
3) Минимальная степень окисления -3
а) РН 3 – фосфин, ядовитый газ с чесночным запахом,
горит: 2РH 3 + 4О 2 = Р 2 О 5 + 3H 2 O,
с некоторыми кислотами дает соли фосфония: РH 3 + HI = РH 4 I
б) фосфиды металлов – ионоковалентные соединения
Mg 3 P 2 + 6 H 2 O = Mg(ОН) 2 + 2РН 3 ,
Са 3 P 2 + 6HСI = CaCI 2 + 2РН 3 .
4) Степень окисления +1
H 3 РO 2 или Н[РO 2 H 2 ] – фосфорноватистая кислота, сильная; соли – гипофосфиты, хорошо растворимы, хорошие восстановители.
5) Степень окисления +3
а) Р 2 О 3 – фосфористый ангидрид, имеет несколько модификаций (Р 2 О 3) n , бесцветные ядовитые кристаллы;
б) H 3 РO 3 или H 2 [РO 3 Н] – фосфористая кислота, средней силы;
в) соли фосфиты, растворимы только у щелочных металлов (К 2 [РO 3 Н]),
РСI 3 + CI 2 = PCI 5 ,
РСI 3 + О 2 = PОCI 3 ,
РСI 3 + НCI ® Н.
6) Максимальная степень окисления +5
а) Р 2 О 5 – фосфорный ангидрид, белый порошок, имеет модификацию (Р 2 О 5) 2 , сильное водоотнимающее средство: Р 2 О 5 + 2H 2 O = 2HРO 3 ;
б) HРO 3 - мета, H 4 Р 2 O 7 –пиро, H 3 РO 4 –ортофосфорная кислота, средней силы;
в) соли мета-, пиро-, орто-фосфаты;
г) галогениды довольно активны:
РСI 5 + 4H 2 O = H 3 РO 4 +5НСI ,
РF 5 + HF = Н.
ОБЩАЯ ХАРАКТЕРИСТИКА ПОДГРУППЫ
7 N, 15 P, 33 As, 51 Sb, 83 Bi. По подгруппе сверху вниз металлические свойства закономерно увеличиваются и это согласуется со значениями степеней окисления, проявляемыми элементами в соединениях, а также с некоторыми физическими свойствами. Хотя аллотропия P, As и Sb создают определённые трудности при сведении физических свойств в единую таблицу:
Таблица 11
Свойства элементов пятой группы, главной подгруппы
Химические свойства
1. С простыми веществами дают самые разные соединения, проявляя различную окислительно-восстановительную природу:
а) восстановительные свойства
2P + 3Cl 2 = 2PCl 3 (или PCl 5);
4As + 5O 2 = 2As 2 O 5 ;
2Bi + 3Cl 2 = 2BiCl 3 .
б) Окислительные свойства
2P + 3Ca = Ca 3 P 2 ;
2As + 3Mg = Mg 3 As 2 .
2. С кислотами реагируют по-разному в зависимости от природы элемента подгруппы:
2P + 5H 2 SO 4 = 2H 3 PO 4 + 5SO 2 + 2H 2 O;
3As + 5HNO 3 + 2H 2 O = 3H 3 AsO 4 + 5NO ;
3Sb + 5HNO 3 = 3HSbO 3 + 5NO + H 2 O;
2Sb + 6Н 2 SO 4 конц. = Sb 2 (SO 4) 3 + 3SO 2 + 6H 2 O;
Bi + 4HNO 3 = Bi(NO 3) 3 + NO + 2H 2 O.
Необходимо помнить, что элементы подгруппы мышьяка в ряду активности стоят после водорода.
3. Гидролиз соединений идёт по-разному:
а) PCl 3 + 3H 2 O = H 3 PO 3 + 3HCl;
BiCl 3 + H 2 O ® BiOCl ¯ + 2HCl.
(SbCl 3) (SbOCl)
б) NaNO 2 + H 2 O Û HNO 2 + NaOH;
K 3 PO 4 + H 2 O Û K 2 HPO 4 + KOH;
K 3 AsO 4 + H 2 O Û K 2 HAsO 4 + KOH.
4. Изменение кислотно-основных свойств у элементов проявляется по-разному
Таблица 12
Наиболее важные соединения элементов пятой подгруппы
5. Окислительно-восстановительная способность соединений зависит от степени окисления элемента:
а) Э -3 – восстановители
2NH 3 + 6KМnO 4 + 6KOH = 6K 2 MnO 4 + N 2 + 6H 2 O;
2PH 3 + 4O 2 = P 2 O 5 + 3H 2 O.
окислители :
2KNO 2 + 4H 2 S = 3S + N 2 + K 2 S + 4H 2 O
Э +3 2BiCl 3 + 3SnCl 2 + 18KOH = 2Bi + 3K 2 SnO 3 + 12KCl + 9H 2 O.
восстановители :
10KNO 2 +4KМnO 4 +11H 2 SO 4 =10HNO 3 +4MnSO 4 +7K 2 SO 4 +6H 2 O
в) Э +5 – окислители
Na 3 SbO 4 + 2NaJ + H 2 SO 4 = Na 3 SbO 3 + J 2 + Na 2 SO 4 + H 2 O.
Элементы 6-а группы. (Халькогены )
Строение электронной оболочки: …ns 2 np 4 .
8 O, 16 S, 34 Se, 52 Te, 84 Po(радиоактивен).
КИСЛОРОД и его соединения
Самый распространённый элемент на Земле: 21% (объемных) в воздухе, входит в состав Н 2 О, минералов, органических веществ.
Физические свойства
Существует в виде веществ:
а) «кислород» О 2 – газ без цвета, вкуса, запаха, не ядовит, ; t° кип. = -183°С; ;
б) «озон» О 3 – голубой газ с резким запахом, ядовит, очень сильный окислитель; t° кип. = -111,8°С.
Химические свойства
1. Только в одной реакции кислород является восстановителем:
О 2 + 2F 2 = 2OF 2 ().
2. Во всех остальных случаях кислород – окислитель, особенно если он находится в атомарном состоянии:
а) Окисление простых веществ
2Н 2 + О 2 = 2Н 2 О;
S + O 2 = SO 2 ;
2Ca + O 2 = 2CaO.
б)Окисление сложных веществ
Р 2 О 3 + О 2 = Р 2 О 5 ;
2SO 2 + O 2 = 2SO 3 ;
2PCl 3 + O 2 = 2POCl 3 .
в) Горение сложных неорганических веществ
2H 2 S + O 2 недост. = 2S + 2H 2 O;
2H 2 S + 3O 2 изб. = 2SO 2 + 2H 2 O.
г) Горение органических веществ
СН 4 + 2О 2 = СО 2 + 2Н 2 О;
С 2 Н 5 ОН + 3О 2 = 2СО 2 + 3Н 2 О.
СЕРА и её соединения
В природе встречается в самородном виде; в виде минералов (сульфиды, сульфаты); в нефти; в белках.
Физические свойства
Твёрдая, хрупкая, жёлтого цвета, не растворима в Н 2 О, но растворима в сероуглероде, анилине. Аллотропна: ромбическая сера (a- форма); моноклинная (b - сера); пластическая и др. Наиболее устойчива модификация a (t° пл. » 113°С), ей приписывают состав S 8 .
Химические свойства
Cоединения, проявляя разные степени окисления, имеют разную окислительно-восстановительную способность.
Таблица 13
Наиболее важные соединения серы
1. Сера, взаимодействуя со сложными соединениями, по-разному меняет свою степень окисления:
а) S + 2H 2 SO 4 конц. = 3SO 2 + 2H 2 O ();
б) S + 6HNO 3 конц. = H 2 SO 4 + 6NO 2 + 2H 2 O ();
в) 3S + 6NaOH = 2Na 2 S + Na 2 SO 3 + 3H 2 O
реакция диспропорционирования
2. Соединения S -2
а) H 2 S – сероводород, ядовитый газ с запахом тухлых яиц, сильный восстановитель: 2H 2 S + O 2 = 2S + 2H 2 O;
H 2 S + Cl 2 = 2HCl + S.
б) Раствор Н 2 S – слабая кислота
Н 2 S Û Н + + HS - (К 1 = 6 × 10 -8).
в) Соли – сульфиды; соли щелочных и щелочно-земельных металлов хорошо растворимы, гидролизуются; сульфиды р-, d-металлов практически не растворимы.
г) Сульфиды металлов проявляют основную природу:
K 2 S + H 2 O Û KHS + KOH;
Сульфиды неметаллов проявляют кислотную природу:
SiS 2 + 3H 2 O = H 2 SiO 3 + 2H 2 S.
д) Тиосоли : похожи на обычные соли, в которых атомы О заменены на S:
Na 2 S + CS 2 = Na 2 CS 3 – тиокарбонат натрия;
Na 2 CS 3 + 2HCl = 2NaCl + H 2 CS 3
неустойчива
е) Полисульфиды : сера, подобно кислороду в перекисях, может образовывать соли: Na 2 S раствор + ´S = Na 2 S n – полисульфид натрия (содержат сульфидные мостики – S - S - S - S -).
3. Соединения S +4
а) SO 2 – сернистый газ с резким запахом, ядовит;
б) Раствор SO 2 – сернистая кислота H 2 SO 3 , средней силы
H 2 SO 3 Û Н + + HSO 3 - (К 1 = 1,3 × 10 -2);
в) Соли – сульфиты, хорошо гидролизуются
Na 2 SO 3 + H 2 O Û NaHSO 3 + NaOH.
г) В окислительно-восстановительных реакциях все эти соединения проявляют двойственность:
SO 2 + 2H 2 S = 3S + 2H 2 O;
2SO 2 + O 2 = 2SO 3 .
д) хлористый тионил: SOCl 2
SOCl 2 + 2H 2 O = H 2 SO 3 + 2HCl.
4. Соединения S +6
а) SO 3 – серный ангидрид; аллотропен, сильный окислитель. Очень энергично реагирует с водой
SO 3 + H 2 O ® H 2 SO 4 + 89,1 кДж/моль;
б) H 2 SO 4 – серная кислота, бесцветная маслянистая жидкость; сильная.
H 2 SO 4 конц. – очень сильный окислитель; обугливает бумагу, сахар, дерево:
С + 2H 2 SO 4 конц. = СО 2 +2SО 2 + 2H 2 O.
Индивидуально её поведение с металлами:
при обыкновенной температуре со многими металлами не взаимодействует («пассивирует» Cr, Fe, Al, Zn, …);
при повышенной реагирует почти со всеми металлами, кроме Au и Pt.
Является очень хорошим водоотнимающим средством, т.к. с водой образует гидраты H 2 SO 4 × nH 2 O:
в) Соли : средние – K 2 SO 4 (сульфаты);
кислые – KHSO 4 (гидросульфаты);
купоросы – CuSO 4 × 5H 2 O; ZnSO 4 × 7H 2 O;
квасцы – двойные соли, кристаллогидраты
KAl(SO 4) 2 × 12H 2 O; NH 4 Fe(SO 4) 2 × 12H 2 O.
г) Олеум – раствор SO 3 в H 2 SO 4 , при этом частично идёт реакция
2SO 3 + H 2 O = H 2 S 2 O 7 пиросерная кислота .
д) Хлористый сульфурил SO 2 Cl 2
SO 2 Cl 2 + 2H 2 O = H 2 SO 4 + 2HCl.
е) Пероксосерные кислоты – содержат перекисные мостики
H 2 SO 5 – пероксомоносерная,
H 2 S 2 O 8 – пероксодисерная;
сильные окислители.
ж) Тиосульфаты – содержат серу в разных степенях окисления: S +6 и S -2 ; благодаря наличию S -2 соединения являются сильными восстановителями.
Na 2 S 2 O 3 + Br 2 + H 2 O = 2HBr + S + Na 2 SO 4 .
Соответствующая кислота Н 2 S 2 O 3 (тиосерная) неустойчива:
Na 2 S 2 O 3 +H 2 SO 4 = Na 2 SO 4 + Н 2 S 2 O 3 .
Элементы 7-а группы. (Галогены )
Строение электронной оболочки: …ns 2 np 5 .
9 F, 17 Cl, 35 Br, 53 J, 85 At (радиоактивен). В свободном состоянии существуют в виде двухатомных молекул.
Физические свойства
Ядовиты, с резким запахом F 2 – бледно-желтый газ, t° кип. = -188,2°С;
Cl 2 – зелёно-жёлтый газ; t° кип. = -34,1°С;
Br 2 – красная жидкость; t° кип. = 59,2°С;
J 2 – фиолетовые кристаллы; t° кип. = +185,5°С.
Химические свойства
1) Самый активный – F 2 , в его атмосфере горят даже стекло и вода:
2F 2 + SiO 2 = SiF 4 + O 2 ;
2F 2 + 2H 2 O = 4HF + O 2 .
2) Вышестоящие галогены (как более сильные окислители) вытесняют нижестоящие из различных соединений:
F 2 + 2KCl (KBr, KJ) = 2KF + Cl 2 (Br 2 , J 2).
3) При растворении галогенов воде и растворах щелочей идут реакции диспропорционирования; в зависимости от температуры получают разные продукты реакции:
Cl 2 + H 2 O = HCl + HClO;
Cl 2 + 2NaOH = NaCl + NaClO;
4) Галогеноводороды – все они бесцветные газы (HF благодаря водородным связям образует ассоциаты H x F x).
По ряду: HF – HCl – HBr – HJ прочность связи падает и восстановительные свойства растут:
MnO 2 + 4HCl = Cl 2 + MnCl 2 + 2H 2 O ().
5) При растворении в воде получают сильные кислоты; HJ – самая сильная (исключение составляет слабая фтороводородная кислота:
H 2 F 2 Û H + + HF 2 -)
6) Галогениды элементов имеют различный кислотно-основной характер, который проявляется:
а) в реакциях гидролиза
AlCl 3 + H 2 O Û AlOHCl 2 + HCl;
PBr 3 + 3H 2 O = H 3 PO 3 + 3HBr.
б) в реакциях комплексообразования
2NaF + SiF 4 ® Na 2 ;
по ряду лигандов F - ; Cl - ; Br - ; J - устойчивость комплексов уменьшается.
7) Галогены в высших степенях окисления
а) оксиды: Cl 2 O; (ClO 2) 2 ; (ClO 3) 2 ; Cl 2 O 7 ;
б) кислоты: HClO; HClO 2 ; HClO 3 ; HClO 4 ;
по ряду кислот ® сила возрастает, для кислот и их солей по этому же ряду окислительные свойства уменьшаются.
в) кислоты и их соли при нагревании разлагаются:
г) соединения между галогенами: их известно очень много; состав соответствует положению элементов в Периодической системе (более электроотрицательные элементы стоят в конце формул):
ClF, BrF, JF; ClF 3 , JF 3 ; ClF 5 , ClOF 3 ; BrF 7 , JO 3 F и др.;
имеют кислотный характер: JF 7 + 4H 2 O = 7HF + HJO 4 ;
ClO 3 F + 2NaOH = NaClO 4 + NaF + H 2 O.
Вопросы для закрепления материала:
1.Какое вещество образуется при взаимодействии мышьяка с концентрированной азотной кислотой – а)Аs(NО 3) 3 ? б)H 3 AsO 4 ? в)As 2 О 3 ?
2.Какое вещество реагирует с концентрированной кислотой с выделением свободного хлора – а)СаС1 2 ? б)МпО 2 ? в)СrС1 3 ?